 Biopolímeros para sistemas de administración de medicamentos
Biopolímeros para sistemas de administración de medicamentos
Biopolímeros para sistemas de administración de medicamentos
Publicación: 20 de Enero de 2021
Por: Dr. José Antonio Sánchez Fernández.
Investigador del Departamento de Procesos de Polimerización del Centro
de Investigación en Química Aplicada.
Antecedentes
La interacción polímero-fármaco juega un papel importante en la capacidad de carga de fármacos en un portador y la estabilidad del fármaco en una matriz, lo que afecta la vida propia del portador. El desarrollo de nuevos sistemas de administración de fármacos y nuevas formulaciones es un enfoque potencial y prometedor para aumentar los índices terapéuticos y reducir los efectos secundarios. Sin embargo, no se debe descuidar el equilibrio de un diseño funcional. La modificación apropiada de la superficie permite la conjugación de nanopartículas con una amplia gama de biomoléculas funcionales, lo que permite su liberación y acumulación preferencial en un sitio de acción. Los fármacos dirigidos pueden administrar sus cargas útiles terapéuticas de forma selectiva en las células enfermas, evitando así la toxicidad asociada a la absorción inespecífica en las células sanas.
Un desafío importante en química y biotecnología es desarrollar un método rutinario, sólido y rentable para el sistema de administración de fármacos (DDS). La eficacia del fármaco se puede mejorar manteniendo la concentración dentro de las ventanas terapéuticas. A menudo, estos sistemas de liberación controlada están hechos de una matriz polimérica porosa en la que se incrustan fármacos.
Los sistemas de liberación controlada también se utilizan como implantes para administrar lentamente medicamentos directamente al tejido de interés, como un tumor, por ejemplo. La velocidad de liberación del fármaco viene dictada por la difusión del fármaco fuera de la matriz o por una combinación de difusión y degradación de la matriz.
Estamos en la era de la medicina de precisión y personalizada, donde los medicamentos se adaptarán a las necesidades de cada paciente y luego se entregarán específicamente a las células enfermas. Esto requerirá la optimización de los algoritmos de alineación, atención a las métricas de cobertura de calidad, soluciones personalizadas e interpretación [1].
Los medicamentos dirigidos tienen varias ventajas sobre sus homólogos no dirigidos. Los fármacos dirigidos pueden administrar sus cargas útiles terapéuticas de forma selectiva en las células enfermas, evitando así la absorción inespecífica y la toxicidad asociada a las células sanas [2]. La baja solubilidad y estabilidad del fármaco a menudo reduce la eficacia de un candidato terapéutico prometedor. El DDS se puede formular para mejorar la solubilidad in vivo de fármacos lipofílicos e hidrofóbicos mediante encapsulación en un portador de administración de fármacos para armar polímeros estrella que contienen poli (etilenglicol) (PEG), policaprolactona (PCL) y bromuro de trifenilfosfonio [3] o mediante conjugación con un polímero. Sin embargo, la compatibilidad del polímero y el fármaco se disecciona esencialmente en sus diferentes grupos funcionales [4], que luego se utilizan para determinar las fuerzas de dispersión, las interacciones dipolo-dipolo y los enlaces de hidrógeno del polímero y el fármaco. En este contexto, Samir Mitragotri y su grupo de investigadores realizaron un estudio relevante sobre las barreras fisiológicas para la administración oral de terapias biológicas y describen enfoques de última generación basados en materiales para mejorar la biodisponibilidad de los materiales de administración de fármacos utilizados [5]. Por otro lado, existe una excelente revisión que se ocupa de los sistemas de administración transdérmica de fármacos. Aquí se hace referencia al uso de biopolímeros como soporte para administrar insulina por vía transdérmica6. Como vemos, la liberación del fármaco detalla el crecimiento constante en los tipos de ligandos dirigidos que ahora permite elegir desde pequeñas moléculas orgánicas hasta péptidos, andamios proteicos, aptámeros de ácido nucleico, anticuerpos intactos y fragmentos de anticuerpos para la administración de fármacos a células patológicas. Con esta diversidad de opciones y el aumento de los datos sobre receptores específicos de enfermedades, ahora debería ser posible identificar un ligando para atacar prácticamente cualquier enfermedad humana. De manera similar, con la variedad de espaciadores, enlazadores y cargas útiles terapéuticas ahora disponibles [7].
Existen tres categorías principales de DDS poliméricos: portadores coloidales (micro, nanopartículas, micelas, micro / nanogeles), redes implantables o hidrogeles y conjugados de fármacos poliméricos. La selección de un DDS debe basarse en la naturaleza del fármaco y las propiedades inherentes de los materiales. Las propiedades del fármaco, incluida la química, la solubilidad, la potencia, el sitio de acción y la tasa de eliminación, influyen en la selección adecuada de un DDS que pueda lograr los resultados deseados. La elección de los portadores de medicamentos puede resultar abrumadora. Además de una gama de biocomposites disponibles comercialmente, básicamente no hay límite para el diseño de estructuras anfifílicas gracias a los avances en el diseño de polímeros [8,9].
Biomimética para la estrategia del sistema de administración
La biomimética se define textualmente como el estudio de la formación, estructura o función de sustancias y materiales producidos biológicamente (como enzimas o seda) y de mecanismos y procesos biológicos (como síntesis de proteínas o fotosíntesis) especialmente con el propósito de sintetizar productos similares por mecanismos artificiales que imitar a los naturales [10]. El proceso de formación de materiales que ocurre en los organismos vivos requiere condiciones de reacción mucho más suaves. La biomimética se ha establecido donde los científicos están tomando ideas de la biología para establecer rutas sintéticas para generar materiales útiles.
El sistema de administración de fármacos biomiméticos (BDDS) tiene una estrategia novedosa que funciona imitando las estructuras, funciones y vías biosintéticas únicas de los sistemas biológicos. La biomimética también se puede combinar con técnicas de ingeniería para crear materiales de bioingeniería para combatir infecciones bacterianas. Uno de estos enfoques es la conjugación de moléculas o proteínas con polímeros naturales o semisintéticos, creando un fármaco-polímero de bioingeniería.
Estructuras organometálicas (MOF) para sistemas de administración de
farmacos
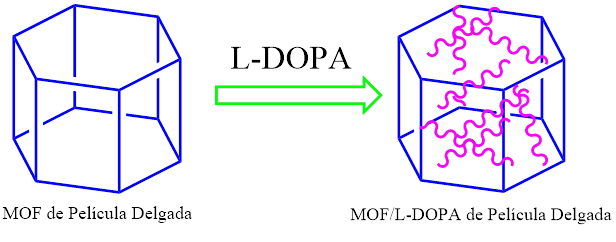
El armazón estructural compuesto de imidazolato zeolítico 8 (ZIF-8), compuesto de iones Zn y ligandos de imidazolato, es una clase de estructuras organometálicas que posee una arquitectura estructural similar a las zeolitas de aluminosilicato convencionales. Este material exhibe propiedades porosas inherentes y alta capacidad de carga, así como una estabilidad térmica y química excepcional. Por otra parte, el monómero quiral L-DOPA (3,4-dihidroxi-L-fenilalanina) se ha introducido en los poros de la estructura orgánica metálica ZIP-8 y luego de un proceso de polimerización con luz Ultravioleta de la L-DOPA se ha formado con éxito la película delgada de poli (L-DOPA) homoquiral y el grabado del SURMOF.ZIF-8 funciona como sistema de administración de medicamento, es decir que el producto basado en MOF y una membrana de matriz mixta es proclive para obtener sistemas de administración focalizada de fármacos.
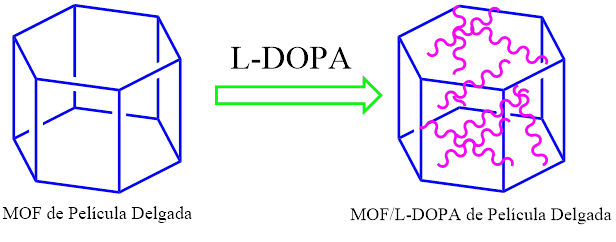
Figura 1. Estructura organometálica y su inserción en L-DOPA.
Referencias
- Ashley, E. A., 2016. Towards precision medicine. Nat. Rev. Genet., 17(9), pp. 507-522.
- Srinivasarao, M. & Low, P. S., 2017. Ligand-targeted drug delivery. Chem. Rev., 117(19), pp. 12133-12164.
- Sharma, A. et al, 2012. Design and evaluation of multifunctional nanocarriers for selective delivery of coenzyme Q10 to mitochondria. Biomacromolecules, 13(1), pp. 239-252.
- Liu, J., Xiao, Y. & Allen, C., 2004. Polymer–drug compatibility: a guide to the development of delivery systems for the anticancer agent, ellipticine. J. Pharm. Sci., 93(1), pp. 132-143.
- Brown, T. D., Whitehead, K. A. & Mitragotri, S., 2020. Materials for oral delivery of proteins and peptides. Nat. Rev. Mater., Volumen 5, pp. 127-148.
- Ng, L. C. & Gupta, M., 2020. Transdermal drug delivery systems in diabetes management: A review. Asian J. Pharm. Sci, 15(1), pp. 13-25.
- Hoogenboom, R., Fijten, M. W., Kickelbick, G. & Schubert, U. S., 2010. Synthesis and crystal structures of multifunctional tosylates as basis for star-shaped poly(2-ethyl-2-oxazoline)s. Beilstein J. Org. Chem., 6(1), pp. 773-783.
- Elsabahy, M. & Wooley, K. L., 2012. Design of polymeric nanoparticles for biomedical delivery. Chem. Soc. Rev., 41(7), pp. 2545-2561.
- Cabral, H. & Kataoka, K., 2014. Progress of drug-loaded polymeric micelles into clinical studies. J. Control. Release, Volumen 190, pp. 465-476.
- Brushan, B., 367. Biomimetics: lessons from nature – an overview. Phil. Trans. R. Soc. A, Volumen 367, pp. 1445-1486.